ASOURCE®TIMES
がん治療に新しい原理に基づいた治療技術が存在感を増してきている。外科、薬物、放射線、免疫療法の4本柱に加え、それぞれの技術の境界を越えた治療法が注目されている。昨年9月に承認された光免疫療法はその象徴だ。

楽天メディカルジャパンは昨年9月、がん局所治療医薬品「アキャルックスⓇ点滴静注250㎎」と医療機器レーザ装置「BioBladeⓇレーザシステム」の双方について製造販売承認を取得した。治療対象は「切除不能な局所進行又は局所再発の頭頸部がん」。これらは光免疫療法と呼ばれる、画期的な治療を実現するための薬剤と医療デバイスだ。
アキャルックスはがん細胞の表面に発現する上皮成長因子受容体(EGFR)を標的とした抗体に色素(IRDyeⓇ 700DX)を結合させた薬剤。がん患者に投与すると、EGFRを発現するがん細胞に選択的に結合する性質がある。一方のBioBladeレーザシステムは波長690nmのレーザ光を照射してIR700を励起させるPDT半導体レーザ装置。がん細胞表面に結合したアキャルックスのIR700がレーザ光照射を受け励起し化学反応を起こすと、がん細胞の細胞膜を損傷させ、がん細胞を殺すという原理だ。
アキャルックスの抗体部分は一般名をセツキシマブといい、すでに大手製薬会社によって頭頸部がんや大腸がんの治療に使われてきた実績を持つ。抗体だけを使う場合には、がん細胞の増殖のかなめとなる分子の働きを抑制させる、あるいは抗体の結合に伴う種々の免疫機構の活性化によってがん細胞の増殖を抑制・死滅させることを目指す。光免疫療法の場合、セツキシマブは光感受性物質である色素を運ぶ役割を担い、がん細胞に結合した後レーザ光を当て、単体では薬理活性のない色素を、励起により活性化させることによって、強い抗がん効果を期待している。
光免疫療法はその原理からレーザ光が届かないがんには効果を発揮することができない。そうなると皮膚がんや乳がんなど体表面にできるがんしか治療ができないことになってしまう。そこで開発者たちが考えたのが、微小な光ファイバーを患者体内に挿入し、患部にレーザ光を照射するBioBladeレーザシステム(写真)だ。いくつか種類があるが、組織内照射用のディフューザーは全長が200㎝で照射部の直径は0.93±0.07mm。
様々ながん治療に抵抗性となった切除不能な局所再発の頭頸部扁平上皮癌患者を対象とした海外第I/IIa相試験の第Ⅱa相パートにおいて30例中、がんが見えなくなる完全奏効は4例(13.3%)、縮小が認められた部分奏効は9例(30%)という成績だった。抗がん薬などが効かなくなった患者集団を対象にした結果としては高い治療効果が認められた。今後、より早期に治療することができれば、この成績はもっと上昇すると期待される。EGFRは食道がんや大腸がん、肺がん、膵臓がんにも発現していることから、今後の適応拡大も期待が高まる。国内において光免疫療法の頭頸部がんの治験を実施した国立がん研究センター東病院では、食道がん・胃がんを対象にした治験を開始している。
この治療の優れているところは、抗体を替えれば、治療範囲を拡大することが可能である点だ。がん細胞に選択的に結合できる抗体を入れ替えて多くのがんの治療に使うことができる、いわゆるプラットフォーム型のがん治療の登場というわけだ。
BioBlade®レーザシステム

他にも薬剤と医療デバイスの合体が進んでいる。たとえば粒子線治療だ。
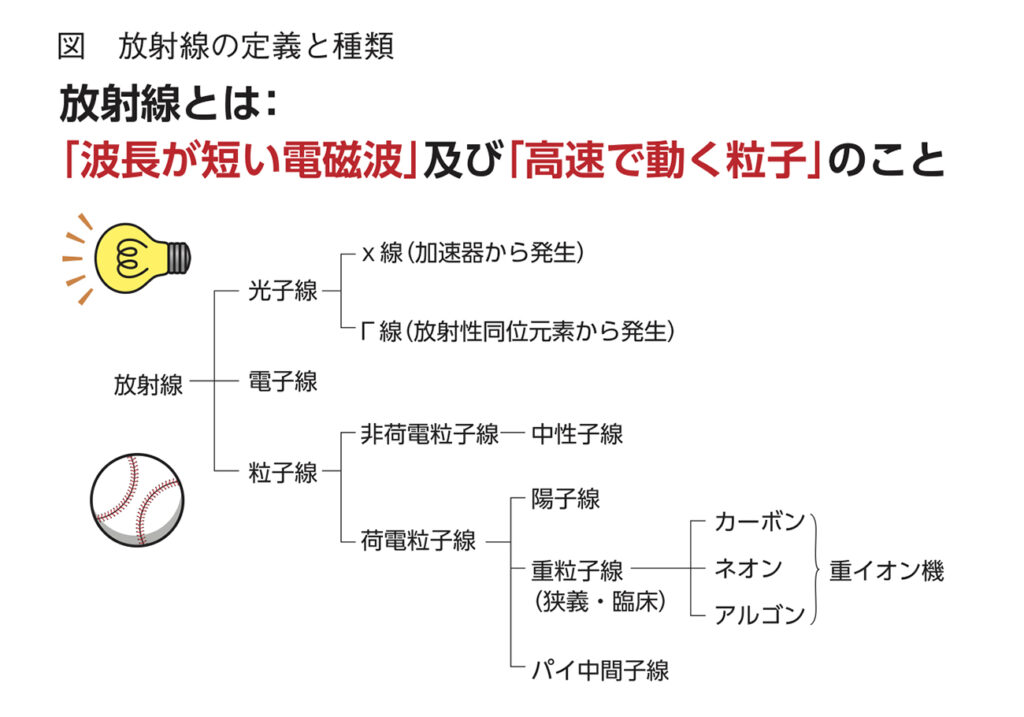
放射線には光子線、電子線、粒子線の3種類(図)あり、通常、がんに対する放射線治療には光子線であるX線が用いられているが、粒子線である陽子線と重粒子線もがんに対して用いることができる。粒子線治療の特徴としては、他の放射線治療と比べ、がん組織に集中してダメージを与えることができ、正常部位に与えるダメージが小さいことが挙げられる。X線は体の表面近くで線量がピークになり、X線の通過する皮膚や周辺の組織を傷害する一方で、粒子線は体の一定の深さで線量がピークとなり、その前後の線量は弱いため、がん組織に線量を集めることができる。また、重粒子線は陽子線に比べて重いことから、がん組織により大きなダメージを与えることが可能だ。
しかし現在、同じ粒子線でも陽子線の施設は全国に17カ所存在するのに対して、重粒子線でがん治療ができる施設は国立研究開発法人・量子科学技術研究開発機構・QST病院(千葉市)や兵庫県立粒子線医療センターなどの6カ所を数えるだけだ(山形と沖縄にも計画中であるのでやがて全国で8カ所になる)。
これは重粒子線治療に大規模な施設と膨大な電力を必要とするためであり、これが普及のネックになっている。しかし、量子科学技術研究開発機構では超小型超電導シンクロトロンやレーザ駆動イオン加速入射機などの開発を進めており、現在の装置がサッカーコート1面分の敷地が必要であるのに対して、それらの技術が完成すれば、20m×10mの区画、つまりテニスコート分の面積があれば十分ということになる。さらに研究が進めばダウンサイズの余地は十分にあり、地域の基幹病院がそれぞれ重粒子線装置を保有することも夢ではなくなる。
現時点ではがん治療の中心は外科手術だが、最近は高齢患者が増えていることから、今後、侵襲性の高い手術を敬遠して重粒子線を選択するケースの増加も予想される。また術前にX線や重粒子線を照射し、がんを小さくしてから範囲を狭めた手術を行う例も増えており、それぞれの治療法の特性の組み合わせが、がん治療のフロンティアになりつつある。
1994年から日本で重粒子線治療を行っている放射線医学総合研究所では、重粒子線と免疫チェックポイント阻害薬を併用するための研究を開始している。この目的の1つに、がんに放射線を照射すると照射していないがんにまで縮小や消失が観察される、アブスコパル効果を高めるというものがある。アブスコパル効果は、照射によって傷害を受け血液中に放出されたがん細胞の抗原が、患者の免疫反応を誘発し、照射していないがん細胞も免疫細胞により攻撃される現象であるとされる。この原理は放射線治療の新原理として期待されているが、頻度が非常にまれである。これはがん細胞に対する免疫反応が、免疫逃避機構によって阻害されていると考えられるためである。そこで、免疫チェックポイント阻害剤を用いて、この免疫逃避機構を解除しようとする狙いなのだ。
治療薬と診断薬は異なった企業が開発するという固定観念を払拭するのはセラノスティックスという新しい考えだ。セラピー(治療)とダイアグノスティックス(診断)の造語であり、この分野で先行しているのがドイツである。ドイツでは前立腺がんに特異的に結合するペプチドに粒子線の1種であるα線を放出する原子(放射性核種)を結合した薬剤で、進行した前立腺がん患者を治療する研究が試みられている。全身に転移した前立腺がんをきれいに消滅させてしまった症例も報告され、注目されている。
放射性核種は診断によく用いられている。がん細胞に取り込ませ、微小ながんの存在を検出する陽子線放出トモグラフィー、いわゆるPET検査だ。これは、がん細胞が好んで吸収するブドウ糖に放射性核種で標識した化合物を造影剤として使う。もしこの放射性核種が発する放射線にがん細胞を攻撃する効果があれば、正確な診断と同時にがん細胞に選択的な治療を行うことが可能になる。こうした発想から生まれたセラノスティックスは革新的ながん治療原理として注目されている。
放射性核種のトップメーカーである日本メジフィジックスは2019年に千葉県袖ケ浦市に「セラノスティックス開発センター」を設立、がん治療薬の開発に参入している。従来、放射線核種によってがんを治療する場合には比較的扱いやすいβ線が主流であったが、日本メジフィジックスは被曝ダメージとエネルギーの大きいα線を利用したセラノスティックスの開発に力を注ぐ。この技術が確立すれば、光免疫療法と同じく、抗体やペプチドを替えて、様々ながんの治療に応用することが可能になる。
21世紀に入って分子標的治療薬や免疫チェックポイント阻害薬が登場し、がん治療は飛躍的な発展を遂げた。しかし、薬剤単独であげられる成果は限界に近付いている。今後は医療機器の革新ががんの診断のみならず、治療をも牽引することになりそうだ。